Pertanyaan Diagnostik: |
Ketika Anda memompa ban sepeda, Anda memasukkan gas atau udara ke dalam ban dengan cara menekan piston pompa. Menurut pemahaman Anda, besaran Fisika apakah yang dapat diukur pada proses tersebut? |
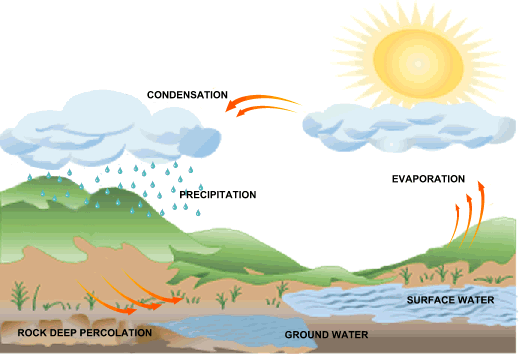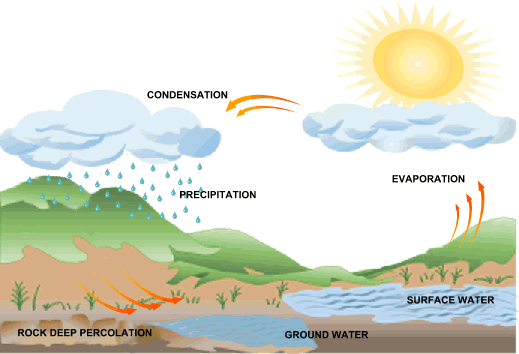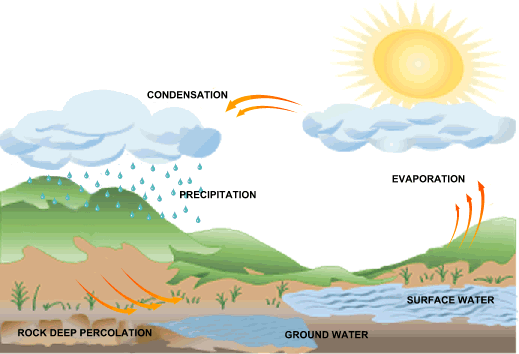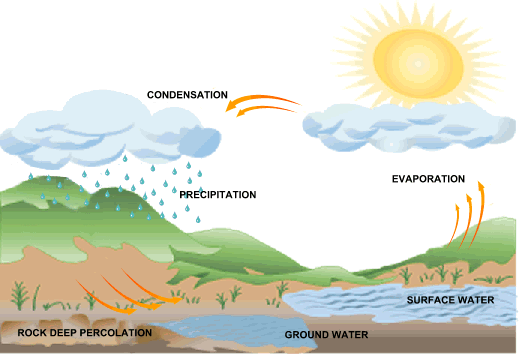 |
Udara dapat bergerak dari tempat bersuhu tinggi ke tempat bersuhu rendah. Menurut Anda, mengapa hal tersebut dapat terjadi? |
A. Persamaan Gas Ideal
1. Gas Ideal

Anda tentu telah mengetahui bahwa setiap zat, baik itu zat padat, cair, maupun gas, terdiri atas materi-materi penyusun yang disebut atom. Sebagai partikel penyusun setiap jenis zat yang ada di Bumi dan di seluruh alam semesta, atom-atom berukuran sangat kecil dan tidak dapat dilihat, walaupum menggunakan alat yang paling canggih. Oleh karena itu, gaya yang ditimbulkan oleh interaksi antarpartikel dan energi setiap partikel hanya dapat diamati sebagai sifat materi yang dibentuk oleh sejumlah partikel tersebut secara keseluruhan. Analogi pernyataan ini dijelaskan sebagai berikut. Misalkan, Anda memiliki sejumlah gas oksigen yang berada di dalam tabung tertutup. Jika Anda ingin mengetahui gaya-gaya yang bekerja pada setiap atom oksigen, Anda hanya dapat mengamati perilaku seluruh gas oksigen yang ada di dalam tabung dan menganggap bahwa hasil pengamatan Anda sebagai penjumlahan dari gaya-gaya yang bekerja pada setiap atom gas oksigen.
Sifat mekanika gas yang tersusun atas sejumlah besar atom-atom atau molekul-molekul penyusunnya dijelaskan dalam teori kinetik gas. Dalam menjelaskan perilaku gas dalam keadaan tertentu, teori kinetik gas menggunakan beberapa pendekatan dan asumsi mengenai sifat-sifat gas yang disebut gas ideal.
Sifat-sifat gas ideal dinyatakan sebagai berikut.
1. Jumlah partikel gas sangat banyak, tetapi tidak ada gaya tarik menarik (interaksi) antarpartikel.
2. Setiap partikel gas selalu bergerak dengan arah sembarang atau acak.
3. Ukuran partikel gas dapat diabaikan terhadap ukuran ruangan tempat gas berada.
4. Setiap tumbukan yang terjadi antarpartikel gas dan antara partikel gas dan dinding bersifat lenting sempurna.
5. Partikel gas terdistribusi merata di dalam ruangan.
6. Berlaku Hukum Newton tentang gerak.
Pada kenyataannya, tidak ditemukan gas yang memenuhi kriteria gas ideal. Akan tetapi, sifat itu dapat didekati oleh gas pada temperatur tinggi dan tekanan rendah.
2. Hukum-Hukum tentang Gas
Teori kinetik gas membahas hubungan antara besaran-besaran yang menentukan keadaan suatu gas. Jika gas yang diamati berada di dalam ruangan tertutup, besaran-besaran yang menentukan keadaan gas tersebut adalah volume (V), tekanan (p), dan suhu gas (T). Menurut proses atau perlakuan yang diberikan pada gas, terdapat tiga jenis proses, yaitu isotermal, isobarik, dan isokhorik. Pembahasan mengenai setiap proses gas tersebut dapat Anda pelajari dalam uraian berikut.
a. Hukum Boyle
Perhatikanlah Gambar 8.1 berikut.
Suatu gas yang berada di dalam tabung dengan tutup yang dapat diturunkan atau dinaikkan, sedang diukur tekanannya. Dari gambar tersebut dapat Anda lihat bahwa saat tuas tutup tabung ditekan, volume gas akan mengecil dan mengakibatkan tekanan gas yang terukur oleh alat pengukur menjadi membesar. Hubungan antara tekanan (p) dan volume (V) suatu gas yang berada di ruang tertutup ini diteliti oleh Robert Boyle.
Saat melakukan percobaan tentang hubungan antara tekanan dan vol- ume gas dalam suatu ruang tertutup, Robert Boyle menjaga agar tidak terjadi perubahan temperatur pada gas (isotermal). Dari data hasil pengamatannya, Boyle mendapatkan bahwa hasil kali antara tekanan (p) dan volume (V) gas pada suhu tetap adalah konstan. Hasil pengamatan Boyle tersebut kemudian dikenal sebagai Hukum Boyle yang secara matematis dinyatakan dengan persamaan
Dalam bentuk grafik, hubungan antara tekanan (p) dan volume (V) dapat dilihat pada Gambar 8.2.

b. Hukum Gay-Lussac
Gay-Lussac, seorang ilmuwan asal Prancis, meneliti hubungan antara volume gas (V) dan temperatur (T) gas pada tekanan tetap (isobarik). Perhatikanlah Gambar 8.3.
Misalnya, Anda memasukkan gas ideal ke dalam tabung yang memiliki tutup piston di atasnya. Pada keadaan awal, gas tersebut memiliki volume 4 m3 dan temperatur 300 K.
Jika kemudian pemanas gas tersebut dimatikan dan gas didinginkan hingga mencapai temperatur 225 K, volume gas itu menurun hingga 3 m3. Jika Anda membuat perbandingan antara volume terhadap suhu pada kedua
Berdasarkan hasil penelitiannya mengenai hubungan antara volume dan temperatur gas pada tekanan tetap, Gay-Lussac menyatakan Hukum Gay- Lussac, yaitu hasil bagi antara volume (V) dengan temperatur (T ) gas pada tekanan tetap adalah konstan. Persamaan matematisnya dituliskan sebagai berikut.
Agar Anda dapat lebih memahami Hukum Boyle dan Hukum Gay- Lussac, lakukanlah kegiatan Mahir Meneliti 8.1.
c. Hukum Charles
Seorang ilmuwan Perancis lainnya, Charles, menyatakan hubungan antara tekanan (p) terhadap temperatur (T) suatu gas yang berada pada volume tetap (isokhorik). Hasil penelitiannya kemudian dikenal sebagai Hukum Charles yang menyatakan hasil bagi tekanan (p) dengan temperatur (T) suatu gas pada volume tetap adalah konstan. Persamaan matematis dari Hukum Charles dinyatakan dengan
Anda dapat melakukan kegiatan Mahir Meneliti 8.2 berikut secara berkelompok untuk lebih memahami Hukum Charles.
d. Persamaan Keadaan Gas Ideal
Pada proses isobarik, tekanan gas tetap, sedangkan volume dan temperatur gas berubah. Demikian juga dalam proses isokhorik dan isotermal, terdapat satu variabel atau besaran gas yang berada dalam keadaan tetap, sedangkan kedua variabel gas lainnya berubah. Bagaimanakah jika ketiga besaran yang menyatakan keadaan gas tersebut (tekanan, volume, dan suhu) berubah?
Dari ketiga hubungan antara tekanan, volume, dan suhu gas yang didapatkan dari Hukum Boyle dan Hukum Gay-Lussac dapat diturunkan suatu persamaan yang disebut persamaan keadaan gas ideal. Secara matematis, persamaan keadaan gas ideal dinyatakan dengan persamaan
Oleh karena setiap proses yang dilakukan pada gas berada dalam ruang tertutup, jumlah molekul gas yang terdapat di dalam ruang tersebut dapat ditentukan sebagai jumlah mol gas (n) yang jumlahnya selalu tetap. Anda tentu sudah mengetahui bahwa mol adalah suatu besaran yang digunakan untuk menyatakan massa suatu zat dalam gram yang besarnya sama dengan jumlah molekul zat tersebut. Dengan demikian, persamaan keadaan gas ideal dapat dituliskan menjadi
Anda telah mempelajari bahwa massa jenis suatu zat adalah perbandingan antara massa dengan volume zat tersebut. Oleh karena itu, dari Persamaan (8–11) dapat diperoleh persamaan massa jenis gas
Menurut prinsip Avogadro, satu mol gas mengandung jumlah molekulgas yang sama. Jumlah molekul gas ini dinyatakan dengan bilangan Avogadro (NA) yang besarnya sama dengan 6,02 × 10^23 molekul/mol. Dengan demikian, Persamaan (8–12) dapat dinyatakan menjadi
Oleh karena nilai pada Persamaan (8–13) merupakan suatu nilai tetapan yang disebut konstanta Boltzmann, k, di mana k = 1,38 × 10^–23 J/K maka persamaan keadaan gas ideal dapat juga dituliskan menjadi persamaan berikut.


























